den 9 oktober 2025
Molekylär livvakt” gör infektioner svåra att bli av med

Forskare vid Umeå universitet har identifierat en viktig molekyl som hjälper bakterier att överleva den fientliga miljön inuti kroppen. Deras studie avslöjar hur proteinet RfaH fungerar som en skyddande sköld för bakteriegener – och pekar på nya strategier för att bekämpa ihållande infektioner.

Kemal Avican
Forskare. Foto: Hans Karlsson.

Atomkraftsmikroskopibild av Yersinia pseudotuberculosis-celler
Som saknar RfaH-proteinet och växer under höga salthalter.
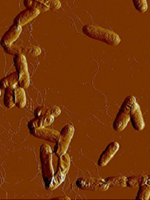
Eftersom bakterierna inte har RfaH har de defekta ytor
Som gör att de klumpar ihop sig i en stressig miljö med högt saltinnehåll.
– Människokroppen är en mycket stressig plats för bakterier. Under infektion attackerar immunförsvaret, näringsämnen är knappa och bakterierna exponeras för gallsalter, syror och värme. Vi har upptäckt hur RfaH hjälper bakterier att hantera den stressen genom att aktivera rätt överlevnadsgener vid rätt tidpunkt, säger Kemal Avican, forskare på Institutionen för molekylärbiologi och Icelab vid Umeå universitet, som lett studien.
Ihållande bakterieinfektioner utgör en stor utmaning inom sjukvården: bakterier kan finnas kvar i kroppen långt efter att de akuta symtomen avtar, de undviker immunförsvaret och överlever antibiotikabehandling. Vid sjukdomar som tuberkulos leder detta till återfall och försvårar behandlingen.
Håller kritiska gener påslagna
Med hjälp av tarmbakterien Yersinia pseudotuberculosis som modell visar Kemal Avican och hans team att molekylen RfaH är avgörande för att en bakteriell infektion blir ihållande.
– RfaH fungerar som en slags ”molekylär livvakt” och ser till att transkriptionen – steget där DNA kopieras till en budbärarmolekyl som styr proteinproduktionen – fullföljs till slutet.
Proteinet hoppar på transkriptionsmaskineriet och hjälper det att hålla sig på rätt spår så att hela genuppsättningen läses av. Detta gör RfaH till en anti-terminator – det förhindrar att transkriptionen avbryts i förtid, förklarar Kemal Avican. – När vi tog bort RfaH minskade bakteriernas förmåga att etablera en långvarig infektion dramatiskt, tillägger han.
Många bakteriella gener är arrangerade i en följd av besläktade gener, kallade operoner, vilka tillsammans reglerar genuttrycket på ett koordinerat sätt. RfaH säkerställer att bakterier kan producera ytstrukturer, utsöndra gifter och motstå stress från kroppens försvar.
Överlever stress i en fientlig miljö
Forskarna fann att RfaH-produktionen ökar just när bakterier behöver det som mest – i sena tillväxtstadier och när förhållandena blir ogästvänliga.
I mössförsök var skillnaden markant: nästan alla djur blev infekterade med normala bakterier, men bara ungefär en av fem blev infekterad när bakterier saknade RfaH. Detta ledde till mycket högre överlevnadsnivåer bland mössen.
Forskningen visade att RfaH styr produktionen av en nyckelkomponent på bakteriers yta – O-antigenet. Utan RfaH blir detta yttre lager defekt. Men RfaHs effekter sträcker sig längre än så och aktiverar många ”nedströmsgener" involverade i vidhäftning, rörelse och näringstransport.
Lovande för antimikrobiell behandling
RfaH i sig finns i många bakterier, inklusive ofarliga sådana i mikrobiotan. Men det är just dessa ”nedströmsgener”, gener som aktiveras av en annan gen eller signal tidigare i en biologisk process, som skulle kunna bli lovande nya selektiva mål för att stoppa ihållande infektioner, menar forskarna.
– En sådan antimikrobiell metod skulle kunna avväpna patogena bakterier utan att störa de nyttiga, säger Joram Kiriga Waititu, postdoktor på Institutionen för molekylärbiologi vid Umeå universitet och förstaförfattare till studien.
Medan Yersinia pseudotuberculosis vanligtvis orsakar en infektion som kroppen kan hantera och läka ut på egen hand hos oss, fungerar den som en värdefull modell för tarmbakterier som orsakar långvariga eller återkommande sjukdomar, till exempel Escherichia coli, Salmonella och Helicobacter. Därmed kan resultaten bana väg för nya strategier att angripa svårbehandlade tarminfektioner.
Om den vetenskapliga studien: Waititu JK, Nilsson K, Larrouy-Maumus G, Costa TRD, Avican K.0.: RfaH is essential for virulence and adaptive responses in Yersinia pseudotuberculosis infection. mBio0:e02122-25. Läs hela artikeln
Källa: Umeå universitet.