den 20 augusti 2024
Kartläggning av malaria i levern öppnar för effektivare malariabehandling
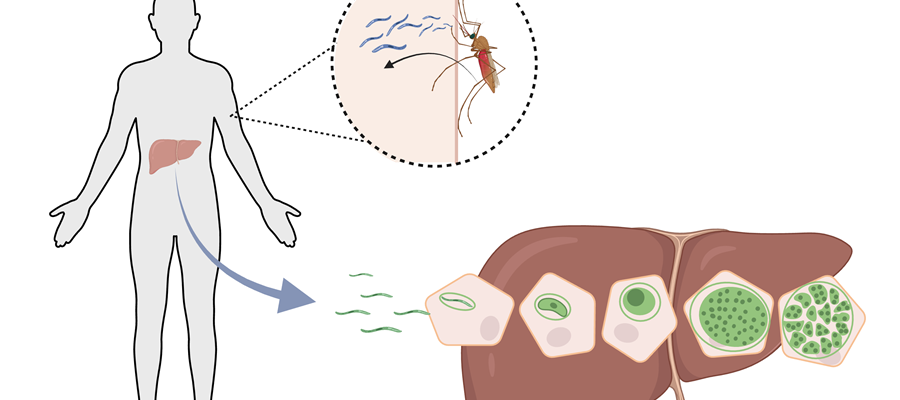
När malariaparasiten kommer in i kroppen efter ett bett av en infekterad Anopheles-mygga, måste den först infektera och föröka sig i levern för att kunna sprida sig till blodet, där den orsakar svåra symptom och över 600 000 dödsfall per år. Med hjälp av den senaste genforskningsteknologin har forskare vid Stockholms universitet för första gången lyckats kartlägga genuttrycket vid malariainfektion i levern. Forskningen som publicerats i Nature Communications, ger ny kunskap som öppnar för effektivare läkemedel och vacciner i framtiden.

Johan Ankarklev
Lektor. Foto: Sören Andersson.

Franziska Hildebrandt
Förste författare. Foto: Stockholms universitet.
– Det ger oss helt nya möjligheter att utforska interaktionen mellan värd och parasit direkt i vävnaden. Med hjälp av tusentals regioner i mikrometerskala, som täcker hela vävnadssnittet, kan vi studera det lokala genuttrycket, vilket hjälper oss att mer specifikt förstå hur immunsvaret är koordinerat under parasitens utveckling i levern, säger Johan Ankarklev, lektor vid Institutionen för molekylär biovetenskap, Wenner-Grens Institut (MBW), och ansvarig för studien.
Studien, som genomfördes vid Stockholms universitet, gjordes i samarbete med forskare vid Kungliga Tekniska Högskolan (KTH), samt Karolinska Institutet i Stockholm, National Institutes of Health (NIH) i Maryland, USA, och The Flemish Institute for Biotechnology i Gent, Belgien.
Kombinationen av så kallad ”spatial transcriptomics” och ”single-nuclei RNA-sequencing” gjorde det möjligt för forskarna att kartlägga genuttrycket över hela den malaria-infekterade vävnaden i leversnitt för första gången. Metoden och studieupplägget, där forskarna följt infektionen hela vägen från det tidiga till det sena stadiet i levern, gör det också möjligt att kartlägga regionala avvikelser i vävnader mellan olika tillstånd och vid olika tidpunkter efter infektion.
Fakta om Malaria
Malaria, som är en av världens dödligaste sjukdomar, uppskattas infektera omkring 230 miljoner människor och orsaka över 600 000 dödsfall varje år, framförallt bland barn under fem år. Symtomen visar sig först när malariaparasiten har nått blodomloppet. Men innan parasiterna når blodstadiet genomgår de först ett kliniskt tyst utvecklingsstadium i levern. Varje enskild parasit som kommer in i levern ger upphov till tiotusentals parasiter, som så småningom släpps ut i blodomloppet, där de infekterar de röda blodkropparna och sedan multipliceras till miljarder nya parasiter.
Vacciner som visat låg effekt och saknar förmågan att ge ett långvarigt skydd
Eftersom leverstadiet är en flaskhals i parasitens livscykel är den enligt Johan Ankarklev ett optimalt mål för effektiva vacciner mot malaria. Något som hittills inte uppnåtts, trots att två nya vaccinationsstrategier nyligen lanserats.
– I jämförelse med blodstadiet så är leverstadiet i malarialivscykeln fortfarande understuderat och utvecklingen av ett effektivt vaccin hämmas just nu av bristen på information rörande detta stadie. Studien bidrar med betydande kunskap för att kunna ta viktiga kliv framåt, säger Johan Ankarklev.
Forskargruppen upptäckte bland annat att parasiten orsakar förändringar i genuttrycket av värdceller i dess närhet och på så sätt undviker värdens immunsvar genom att ta över kontrollen över leverns funktioner.
– Under tidig infektion av levern ser vi pro-inflammatoriska genuttryck hos värden i det lokala området nära parasiter, men under det sena stadiet av infektionen ser vi en nedreglering av dessa immun-relaterade gener. Istället ser vi en uppreglering av gener relaterade till fettsyrametabolism hos värdceller i lokala områden nära parasiten, säger Franziska Hildebrandt, före detta doktorand vid AnkarklevLab och förste författare till studien.
Fettsyror är avgörande för parasiten under det sena stadiet, där parasiten går igenom massiv celldelning. Det har även beskrivits att fettsyror är involverade i anti-inflammatoriska svar.
– Vår hypotes är därför att parasiten slår två flugor i en smäll, då vår data visar att den både undgår immunförsvaret och samtidigt förser sig själv med nödvändig näring genom att ”kapa” regleringen av värd cellernas uttryck av gener som kodar för fettsyrametabolism, tillägger Franziska Hildebrandt.
Hitta studien "Host-Pathogen Interactions in the Plasmodium-Infected Mouse Liver at Spatial and Single-Cell Resolution" i Nature Communications.
DOI: https://doi.org/10.1038/s41467-024-51418-2
Läs mer i den engelska versionen (publicerad på Alpha Galileo).
Källa: Stockholms universitet.